Resumos
O conhecimento da anatomia normal da árvore ductal pancreática no cão e de sua variações reveste-se de importância para a execução dos protocolos de preparação e isolamento das ilhotas de Langerhans. A proposta deste estudo é demonstrar a configuração anatômica da dutal pancreática com especial atenção para as implicações sobre as técnicas de preparação do tecido pancreático para o transplante de ilhotas de Langerhans no cão. Os autores realizaram a dissecção do duto pancreático principal (Santorini) e a cateterização dos seus ramos ascendente e descendente. Em seguida procederam à pancreatectomia total sem duodenectomia. Através destes cateteres, infundiu-se solução de acetona no interior dos ductos e solução de tinta nanquim de cor azul no ramo ascendente e de cor vermelha no ramo descendente. Posteriormente, os autores dissecaram a árvore ductal pancreática com pinças delicadas e digitoclasia. Através desta técnica, os autores verificaram a distensão universal do parênquima pancreático devido ao envolvimento de toda a glândula pelos ramos tributários do ducto pancreático principal. O ramos descendente distendeu exclusivamente a região do processo uncinado, ao passo que o ramo ascendente distendeu exclusivamente as regiões do corpo e cauda do pâncreas canino. Esta constatação enfatiza a utilização destas vias para a infusão das soluções apropriadas nos procedimentos de isolamento das ilhotas de Langerhans no modelo canino.
Ductos pancreáticos; Ilhotas de Langerhans; Pâncreas
The knowledge of normal pancreatic ductal tree anatomy in dogs is important for the preparation and isolation of islets of Langerhans. The aim of this study is to demonstrate the anatomical configuration of the pancreatic ductal tree, especially concerning its implications in the preparation of pancreatic tissue for Langerhans islets transplantation techniques. The main pancreatic duct ( Santorini ) was dissected, and the upper and the lower branches were catheterized. Total pancreatectomy was performed without duodenectomy. Through the catheters an acetone solution was administered to the ducts, a blue ink solution was administered to the upper branch, and a red ink solution was administered to the lower branch. The ductal tree was then carefully dissected. A global distension of the pancreatric parenquima was observed due to the complete envelopment of the gland by the tributary branches of the main pancreatic duct. The lower branch only distended the uncinated process region, and the upper branch only distended the body and tail regions of the pancreatic tissue. This study suggests that the use of these sites of infusion are adequate in the procedures for isolating islets of Langerhans in dogs.
Pancreatic ducts; Islets of Langerhans; Pancreas
Distribuição anatômica da árvore ductal pancreática do cão: Implicações para o isolamento das ilhotas de Langerhans1 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Jaques Waisberg2 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Ricardo Ribeiro Magalhães Cruz2 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Eduardo Ramacciotti3 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Adriana Cristina do Nascimento4 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Eli Szwarc4 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Osíris Ramacciotti5 1 Trabalho realizado na Disciplina de Fundamentos de Cirurgia da Faculdade de Medicina do ABC Santo André. 2 Assistente. 3 Auxiliar de Ensino Voluntário. 4 Acadêmicos Monitores. 5 Professor Titular.
Waisberg J, Cruz RRM, Ramacciotti E, Nascimento AC, Szwarc E, Ramacciotti O. Distribuição anatômica da árvore ductal pancreática do cão: implicações para o isolamento das ilhotas de Langerhans. Acta Cir Bras [serial online] 1999 Abr-Jun;4(2). Available from: URL: http://www.scielo.br/acb.
RESUMO: O conhecimento da anatomia normal da árvore ductal pancreática no cão e de sua variações reveste-se de importância para a execução dos protocolos de preparação e isolamento das ilhotas de Langerhans. A proposta deste estudo é demonstrar a configuração anatômica da dutal pancreática com especial atenção para as implicações sobre as técnicas de preparação do tecido pancreático para o transplante de ilhotas de Langerhans no cão. Os autores realizaram a dissecção do duto pancreático principal (Santorini) e a cateterização dos seus ramos ascendente e descendente. Em seguida procederam à pancreatectomia total sem duodenectomia. Através destes cateteres, infundiu-se solução de acetona no interior dos ductos e solução de tinta nanquim de cor azul no ramo ascendente e de cor vermelha no ramo descendente. Posteriormente, os autores dissecaram a árvore ductal pancreática com pinças delicadas e digitoclasia. Através desta técnica, os autores verificaram a distensão universal do parênquima pancreático devido ao envolvimento de toda a glândula pelos ramos tributários do ducto pancreático principal. O ramos descendente distendeu exclusivamente a região do processo uncinado, ao passo que o ramo ascendente distendeu exclusivamente as regiões do corpo e cauda do pâncreas canino. Esta constatação enfatiza a utilização destas vias para a infusão das soluções apropriadas nos procedimentos de isolamento das ilhotas de Langerhans no modelo canino.
DESCRITORES: Ductos pancreáticos. Ilhotas de Langerhans. Pâncreas.
INTRODUÇÃO
O estudo da árvore ductal pancreática no cão é de especial interesse para a investigação experimental do transplante das ilhotas de Langerhans. A maioria dos protocolos de preparação do tecido pancreático para o transplante autólogo ou homólogo das ilhotas de Langerhans em cães inclui o procedimento da infusão de soluções nutrientes com quantidades variáveis da enzima colagenase no interior dos ductos pancreáticos com o objetivo de promover a dispersão intralobular do órgão, etapa essencial para obter-se o adequado isolamento das ilhotas de pancreáticas4,6,9,13. A técnica de infusão de tais soluções através da cateterização única do ducto pancreático principal ou da cateterização separadamente dos seus ramos ascendente ou superior e descendente ou inferior, ou ainda, através de punção direta no parênquima pancreático não está definida nos diversos protocolos de isolamento das ilhotas pancreáticas 3,4, 6,10,12,15.
Deste modo, procuramos estudar a configuração anatômica da árvore ductal pancreática do cão com especial atenção para as implicações sobre as técnicas de distensão parenquimatosa na etapa de preparação do tecido pancreático para o transplante das ilhotas de Langerhans no modelo canino.
MÉTODO
Foram utilizados 15 cães adultos jovens sem raça definida. Como fatores de inclusão no estudo foram considerados: estado aparente de higidez , peso corpóreo situado entre 8 a 12 quilogramas (kg) à admissão e sexo masculino. As intervenções operatórias foram realizadas no laboratório do Setor de Técnica Operatória e Cirurgia Experimental da Faculdade de Medicina do ABC. Os animais permaneceram 12 horas de jejum previamente à operação. O anestésico utilizado foi o pentobarbital sódico (Nembutal, Abott Laboratório do Brasil, São Paulo) na dosagem de 25 miligramas (mg) por kg de peso corpóreo, diluído em água destilada e injetado através de punção venosa periférica na veia radial de uma das patas dianteiras do animal, técnica semelhante à descrita por FAGUNDES & GOLDENBERG2 . Em seguida, os animais foram colocados na mesa cirúrgica e submetidos à entubação orotraqueal com sonda provida de pequeno balão; os cães foram mantidos sob respiração com pressão positiva através de ventilação pulmonar controlada com auxílio de respirador à pressão Takaoka (modelo 600, K. Takaoka, São Paulo) devidamente regulado para fornecer uma freqüência respiratória de 20 movimentos por minuto. A veia radial de uma das patas dianteiras foi cateterizada com tubo de polietileno com diâmetro 6 French (Fr) e mantida para gotejamento de solução de cloreto de sódio a 0,9 por cento. Os animais anestesiados foram colocados em decúbito dorsal horizontal sobre uma goteira com os membros anteriores e posteriores fixados em extensão. Após tricotomia das regiões anterior e lateral do tórax, abdômen e das regiões ínguino-crurais foi realizada a anti-sepsia do campo operatório com polivinil-pirrolidona-iodo em solução aquosa tópica, o qual a seguir foi delimitado com panos estéreis ao redor da linha média da parede abdominal. Em todos os animais operados foi realizada a laparotomia através de incisão mediana e abertura da parede abdominal por planos. Exposta a cavidade abdominal, as bordas da parede abdominal foram protegidas por compressas de pano e as bordas da incisão foram afastadas com o auxílio do afastador auto-estático de Gosset. Em seguida, procedeu-se a identificação do pâncreas em toda a sua extensão. Com o auxílio de pinças vasculares delicadas e reparado por dois fios de algodão 4-0, o ducto pancreático principal foi isolado imediatamente antes da sua penetração na parede duodenal. Através de dissecção romba com gaze e pinça vascular, o ramo ascendente e o ramo descendente do ducto pancreático principal foram isolados do parênquima circundante e reparados com fio de algodão 4-0. Em seguida, com o auxílio de lupa (Horizon Medical Inc, EUA) com aumento de 2,5x, seus ramos ascendente e descendente foram abertos com o auxílio de tesoura de íris e cateterizados separadamente com cateteres de polivinil com diâmetro 3 Fr direcionados ao pâncreas; o ducto pancreático principal foi ligado e secionado junto à parede duodenal. Em seguida, o pâncreas foi extirpado totalmente, o duodeno preservado e a artéria recorrente duodenal mantida, segundo a técnica descrita por COBB & MERRELL1 modificada por WAISBERG e col.14. Os principais troncos vasculares pancreáticos (vasos gastroduodenais e ramos dos vasos mesentéricos superiores) foram ligados apenas no término da extirpação da glândula, a fim de diminuir o período de isquemia durante este tempo do procedimento e a glândula removida. A síntese parietal foi realizada através de sutura em massa contínua, chuleio simples com ponto transversal, incluindo peritônio parietal, planos aponeuróticos, musculares e pele com fio de polipropileno monofilamentar 0 munido de agulha triangular curva traumática. Após concluída a síntese da parede abdominal, os animais foram sacrificados através da ministração intravenosa de 20 ml de solução de cloreto de potássio a 19,1 por cento, enquanto ainda anestesiados.
A preparação da árvore ductal pancreática consistiu na injeção de 30 ml de solução de formol a 10% através dos cateteres colocados nos ramos ascendente e descendente do ducto principal; a glândula extirpada permaneceu mergulhada em solução de formol a 10% por 24 horas. Em seguida, introduziu-se aproximadamente 30 ml de solução de acetona aquecida a 37ºC através de cada cateter para provocar o enrijecimento das estruturas ductais pancreáticas o que colaborou para a dissecção firmes de seus ramos. Após esta etapa, infundiu-se em volume variável (20 a 30 ml) solução de tinta tipo nanquim de cor azul no ramo ascendente e de solução de tinta tipo nanquim de cor vermelha no ramo descendente. Procedeu-se, em seguida, à dissecção cuidadosa da árvore ductal pancreática a partir do ducto principal no sentido dos ramos ascendente e descendente até a periferia da glândula utilizando-se pinças vasculares, tesouras delicadas e digitoclasia do parênquima pancreático.
As medidas da extensão do ducto pancreático principal e da distância entre esta estrutura e o ponto de penetração dos vasos pancreaticoduodenais inferiores foram realizadas com o auxílio de régua metálica graduada em milímetros e centímetros.
RESULTADOS
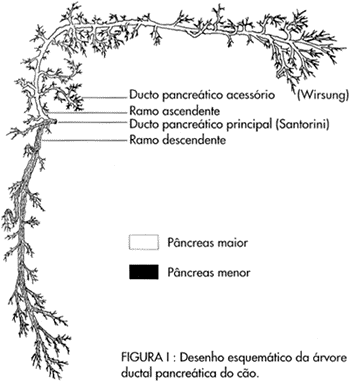
O ducto pancreático principal estava localizado numa posição entre a parede duodenal e o parênquima pancreático, cerca de 3,2 cm em média (2,8 a 4,1 cm) acima do ponto de penetração em que os vasos pancreaticoduodenais inferiores adentravam na intimidade do parênquima pancreático. O ducto pancreático principal apresentou, em todos os animais, extensão média de 0,45 cm (0,3 a 0,5 cm) entre a papila duodenal maior e o início de sua bifurcação quando, então, dividiu-se no ramo ascendente ou superior que se dirigiu para as porções do corpo e cauda do órgão e no ramo descendente ou inferior que se direcionou para a região do processo uncinado do pâncreas canino (figura 1).
Em todos os animais deste experimento, o orifício do ramo descendente do ducto pancreático principal apresentou menor diâmetro do que o do ramo ascendente e maior dificuldade de cateterização.
Com esta técnica, todos os animais estudados apresentaram distensão completa do seu parênquima pancreático. A cateterização diferenciada e a infusão de tinta nanquim nos ramos ascendentes e descendente e a sua distensão pela solução de formol revelou que o ducto pancreático principal através dos seus ramos ascendente e descendente drena toda a glândula pancreática, inclusive a região do parênquima próximo ao ducto pancreático acessório. A infusão de tinta nanquim azul no ramo ascendente coloriu exclusivamente as regiões do corpo e cauda do órgão e a infusão de tinta nanquim vermelha envolveu apenas a porção do processo uncinado do pâncreas (figura 1).
DISCUSSÃO
O transplante das ilhotas pancreáticas como meio de controlar a hiperglicemia diabética e de prevenir as complicações da doença é uma área de grande interesse atual5,6,10,15. O objetivo do transplante das ilhotas pancreáticas nos enfermos portadores de diabetes mellitus insulino dependente é a restauração da secreção insulínica com capacidade de responder adequadamente às demandas e prevenir as amplas flutuações da glicemia, situação que acredita-se ser responsável pelo aparecimento das complicações tardias da doença11,15 .
Nos animais de experimentação, especialmente no cão, a eficácia dos métodos de transplante autólogo ou homólogo no estabelecimento da normoglicemia está na dependência da obtenção de alto rendimento de ilhotas pancreáticas isoladas e funcionalmente viáveis5,14. Um dos pontos críticos para atingir-se este objetivo reside na distensão completa do parênquima pancreático com soluções apropriadas contendo geralmente nutrientes e colagenase. Assim, a escolha da técnica de distensão da glândula pancreática poderá refletir no resultado funcional do transplante.
O pâncreas do cão é dividido anatomicamente em processo uncinado, corpo e cauda7 (figura 1). Uma técnica de distensão que propicie a distensão destas três regiões é, portanto, desejável.
A técnica da pancreatectomia total sem duodenectomia1,14 utilizada neste experimento permitiu a extirpação da glândula pancreática sem períodos de isquemia prolongada, contribuindo para a manutenção da integridade do órgão e favorecendo a técnica dissecção da árvore ductal pancreática.
O ducto pancreático principal jaz numa posição regularmente constante e cranialmente em relação ao ponto onde os vasos pancreaticoduodenais inferiores penetram no parênquima do pâncreas7,8. No presente estudo, o ducto pancreático principal pôde ser identificado antes da sua dissecção como uma extensão da parede duodenal penetrando no pâncreas7. O ducto foi isolado pela dissecção dos vasos e através de dissecção romba delicada. Este ducto tinha curta extensão e se ramificava logo após penetrar na glândula pancreática com um dos ramos em direção ascendente drenando a cabeça, corpo e cauda do órgão e o ramo menor com direção descendente drenando o processo uncinado. Quando a canulação for desejável, o ducto pancreático deve ser aberto pontudamente para permitir a introdução de cateter mais facilmente. A cânula, assim, pode ser colocada nos dois ramos do ducto principal e o suco pancreático fluirá livremente.
A maioria dos protocolos de isolamento das ilhotas de Langerhans para transplante implicam, numa primeira etapa, na perfusão do pâncreas através de cateteres colocados nos ramos ascendente e descendente do ducto pancreático principal, no próprio ducto pancreático principal (Santorini) ou na punção direta com agulha do parênquima pancreático, através da qual são infundidas soluções nutrientes contendo colagenase, com o intuito de promover uma separação enzimática entre o tecido endócrino e o exócrino da glândula pancreática e nutrir as ilhotas durante os procedimentos de isolamento das mesmas3,4,6,12,15. A distensão completa do pâncreas com tais soluções constitui uma premissa para obter-se rendimento adequado de ilhotas de Langerhans viáveis e isoladas do tecido exócrino o que promoverá melhor resultado funcional do transplante 5,11,12,14. Através do presente estudo verificamos que a cateterização separadamente dos ramos ascendente e descendente do ducto pancreático principal (Santorini) promoveu distensão adequada de todo o parênquima pancreático. Este fato pode ser explicado pela constatação, através da dissecção da árvore ductal pancreática, de que os ramos do ducto pancreático principal (Santorini) atingem a totalidade do pâncreas canino.
O estudo detalhado da arborização do sistema ductal pancreático reveste-se de importância na avaliação das técnicas de distensão do parênquima glandular. A introdução de acetona no interior do sistema ductal pancreático teve o objetivo de limpar os ductos maiores e menores de detritos, deixando-os pérvios para a infusão de tinta nanquim e provocar o enrijecimento de suas paredes permitindo, assim, a dissecção dos ramos ductais até os de calibre mais fino e mantendo sua integridade. A cateterização separadamente dos ramos ascendente e descendente e a infusão de tinta nanquim com cores diferentes permitiu observar que o ducto descendente recebe ramos tributários exclusivamente do processo uncinado; já o ramo ascendente drena as regiões do corpo e da cauda do pâncreas do cão. Em nossos levantamentos não encontramos na literatura estudos anatômicos que empregassem a técnica de moldagem através de soluções obliterantes e enrijecedoras da árvore ductal pancreática do cão como a utilizada no presente trabalho.
CONCLUSÕES
Os resultados do presente estudo leva-nos a sugerir que, em função da evidência anatômica da ampla distribuição dos ramos ascendente e descendente do ducto pancreático principal (Santorini) no parênquima glandular verificada no presente estudo, a distensão adequada do pâncreas pode ser realizada através do isolamento do ducto pancreático principal (Santorini) e da infusão de soluções apropriadas separadamente nos seus ramos ascendente e descendente.
Waisberg J, Cruz RRM, Ramacciotti E, Nascimento AC, Szwarc E, Ramacciotti O. Anatomical distribution of pancraatic ductal tree and its implications for isolating Langerhans islets. Acta Cir Bras [serial online] 1999 Jul-Sept;14(3). Available from: URL: http://www.scielo.br/acb
SUMMARY: The knowledge of normal pancreatic ductal tree anatomy in dogs is important for the preparation and isolation of islets of Langerhans. The aim of this study is to demonstrate the anatomical configuration of the pancreatic ductal tree, especially concerning its implications in the preparation of pancreatic tissue for Langerhans islets transplantation techniques. The main pancreatic duct ( Santorini ) was dissected, and the upper and the lower branches were catheterized. Total pancreatectomy was performed without duodenectomy. Through the catheters an acetone solution was administered to the ducts, a blue ink solution was administered to the upper branch, and a red ink solution was administered to the lower branch. The ductal tree was then carefully dissected. A global distension of the pancreatric parenquima was observed due to the complete envelopment of the gland by the tributary branches of the main pancreatic duct. The lower branch only distended the uncinated process region, and the upper branch only distended the body and tail regions of the pancreatic tissue. This study suggests that the use of these sites of infusion are adequate in the procedures for isolating islets of Langerhans in dogs.
SUBJECT HEADINGS: Pancreatic ducts. Islets of Langerhans. Pancreas.
Endereço para correspondência:
Jaques Waisberg
Rua das Figueiras, 550/134
09080-300 Santo André-SP
Tel: (011)444-2461 Fax: (011)444-2160
e-mail: jaqueswaisberg@uol.com.br
Data do recebimento: 28/02/99
Data da revisão: 30/03/99
Data da aprovação: 20/04/99
- 1. Cobb LF, Merrell R. Total pancreatectomy in dogs. J Surg Res 1984; 37:235-40.
- 2. Fagundes DJ, Goldenberg S. Anestesia endovenosa em căes com pentobarbital sódico. Med Cult 1984;39:68-71.
- 3. Gupta V, Wahoff D, Rooney DP, Poitout V, Shuterland DER, Kendall DM, Robertson RP. The defective glucagon response from transplanted intrahepatic pancreatic islets during hypoglicemia is transplantation site-determined. Diabetes 1997;46:28-33.
- 4. Iwashita C, Asano T, Kenmochi T, Jingu K, Uematsu T, Nakagohri T, Hasegawa M, Maruyama M, Miyauchi H, Isono K. Combined method of mechanical chopper and automated two-step digestion technique for islet isolation from canine pancreas. Tranplant Proc 1996;28:337-8.
- 5. Kneteman NM, Warnock GL, Evans MG, Nason RW, Rajotte RV. Prolonged function of canine pancreatic fragments autotransplanted to the spleen by venous reflux. Transplantation 1990;49:679-81.
- 6. Marchetti P, Olack B, Swanson C, Newton M, Scharp DW. Assessment of long-term (1 year) graft survival and metabolic and hormonal changes after intrasplenic canine pancreatic microfragments transplantation. Diabetes Metab 1993;19:17-24.
- 7. Markowitz J, Archibald J, Downie HG. Cirurgia experimental del pancreas. In: Cirurgia experimental y fisiologia quirúrgica. 5nded. México: Interamericana; 1967. p. 226-42.
- 8. Nielsen SW, Bishop EJ. The duct system of canine pancreas. Am J Vet Res 1954;15:267-71.
- 9. OBrien DW, Molnar GD, OBrien DC, Rajotte RV. Portal vein insulin flux and arterial glucose fluctuations in response to an oral meat test in islet cell-transplanted dogs. Pancreas 1994;9:543-9.
- 10. Rilo HL, Carooll PB, Zeng YJ, Fontes P, Demetris J, Ricordi C. Accelleration of chronic failure of intrahepatic canine islet autografts by a short course of prednisone. Transplantation 1994;57:181-7.
- 11. Van der Burg MPM, Guicherit OR, Frölich M, Scherft JP, Bruijn JÁ, Gooszen HG. Impact of donor-related variables on islets isolation outcome in dogs. Diabetologia 1994;37:111-4.
- 12. Waisberg J, Fonseca Filho PP, Araújo MR, Rahal AA, Gonçalves JE, Zanotto A, Speranzini MB. Isolamento das ilhotas de Langerhans pela digestăo do tecido pancreático com colagenase tipo V: estudo experimental em căes. Acta Cir Bras 1987;2:45-50.
- 13. Waisberg J, Gonçalves JE, Cruz RRM, Landman G, Speranzini MB. Technical basis of autotransplantation of islets in the spleen: an experimental study in dogs. Arq Bras Cir Dig 1989;4:14-20.
- 14. Waisberg J, Lima JPC, Dias ARN, Reis GC, Gonçalves JE, Speranzini MB. Pancreatectomia total no căo. Acta Cir Bras 1991;6:68-71.
- 15. Waisberg J, Magalhăes RR, Gonçalves JE, Landman G, Zanotto A, Speranzini MB. Aspectos funcionais do autotransplante de ilhotas de Langerhans no baço: estudo experimental em căes. Acta Cir Bras 1987; 2:121-7.
Datas de Publicação
-
Publicação nesta coleção
30 Nov 1999 -
Data do Fascículo
Set 1999
Histórico
-
Revisado
30 Mar 1999 -
Recebido
28 Fev 1999 -
Aceito
20 Abr 1999